Článek
Chlapec Kyle a Nicole Muldoonových zjevně od svého narození neprospíval. Proč, to se rodiče dozvěděli jen týden po jeho narození: Trpěl vzácnou genetickou chorobou – deficiencí karbamoylfosfátsyntetázy 1 (CPS-1).
Kvůli nepatrné chybě v jednom genu – jednomu špatnému „písmenu“ genetického kódu – tělo malého KJ nedokázalo správně zpracovávat bílkoviny, což vedlo k hromadění pro nás toxického čpavku v jeho těle.
Děti může zachránit transplantace jater. Ale jen zhruba polovina dětí s touto chorobou se dožije věku, kdy mohou transplantaci podstoupit. Vada je tak vážná, že smrt hrozí v podstatě každý den. A pokud ne smrt, tak vážné postižení.
KJ měl ve své smůle to štěstí, že se narodil na správném místě a ve správnou dobu. Lékaři z Dětské nemocnice ve Filadelfii mu dokázali nabídnout první známou „na mírou šitou“ terapii využívající pokročilou variantu CRISPR, takzvaný „base editing“ neboli bázovou editaci. Tento nástroj dokáže zaměnit jedno konkrétní písmenko v genetickém kódu za jiné, aniž by DNA přímo stříhal. Cílem bylo potřeba opravit onu jedinou konkrétní mutaci v miliardách písmen DNA, kterou KJ zdědil od otce.
Mezinárodní tým vědců a lékařů vyvinul tuto terapii „na míru“ za pouhých šest měsíců. „Všechny nutné kroky obvykle trvají deset let, ne-li více,“ řekl pro The New York Times David Liu, hvězda současné molekulární biologie, v jehož laboratoři metoda „base editing“ vznikla.
Když byla zpráva o léčbě zveřejněna, měl za sebou chlapec podání tří dávek, mohl už přijímat doporučené množství bílkovin ve stravě a jeho závislost na lécích se postupně snižuje. Nabral v podstatě normální hmotnost na svůj věk. A i když stále není jasné, zda nebude v budoucnosti potřebovat nová játra, má minimálně velkou šanci dožít se nutného věku ve zdraví.
Případ je tak naprosto extrémní ukázkou možností personalizace medicíny: léku vyvinutého (byť na základě známé technologie) pro jednoho jediného pacienta.
CRISPR: „ukradený“ objev
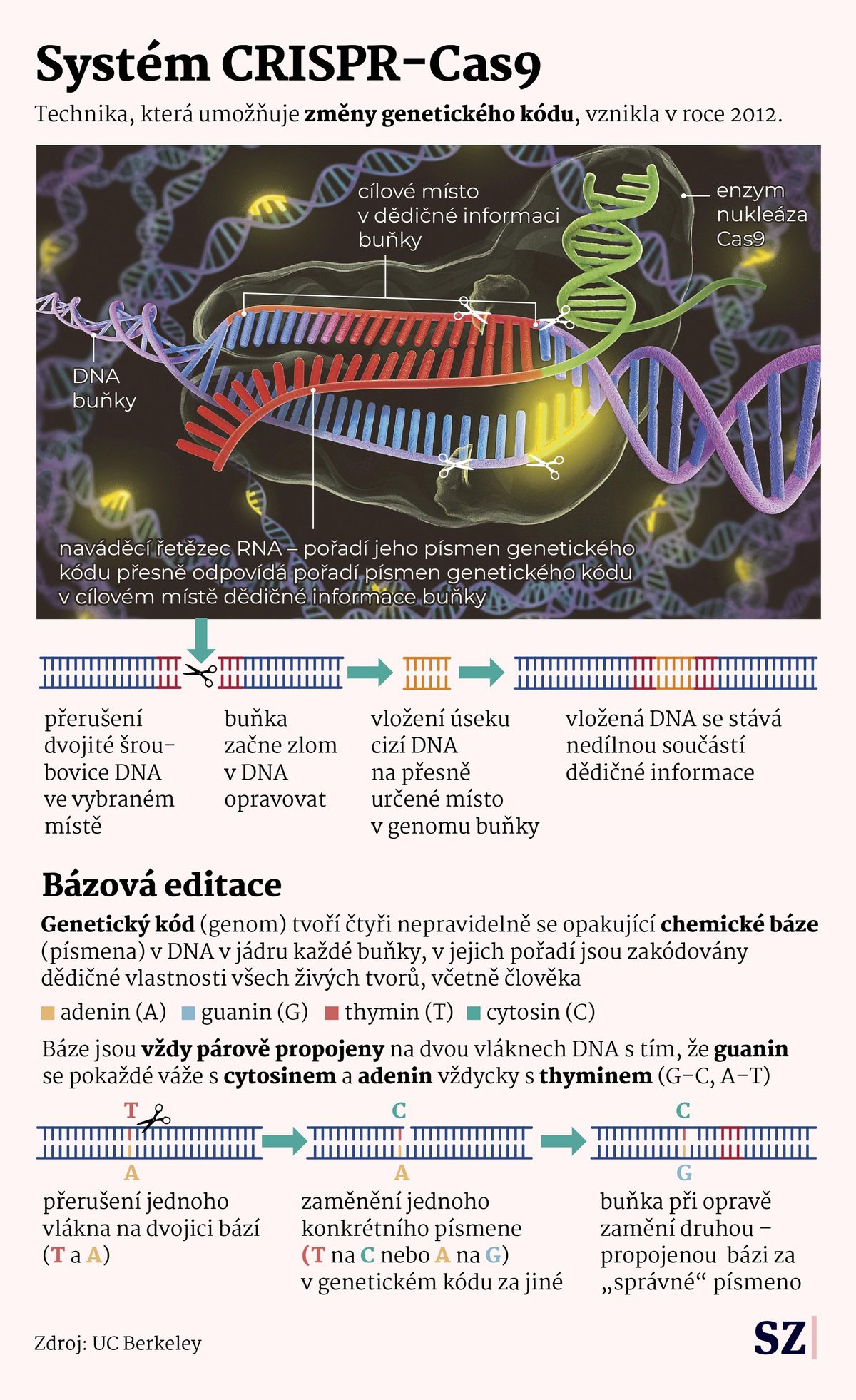
Nástroj CRISPR lidé vlastně vzali bakteriím. Ty ho používají jako imunitní systém při obraně proti virům. V podstatě ho používají tak, aby „rozstříhaly“ DNA virových útočníků a udělaly je tak bezmocnými.
V roce 2012 vědkyně Emmanuelle Charpentierová a Jennifer Doudnaová ukázaly, že tento nástroj lze proměnit v univerzální a programovatelné molekulární nůžky. Obě si za to po pouhých devíti letech od objevu odnesly Nobelovu cenu.
Pro genetické inženýrství to znamenalo revoluci; najednou tu byl nástroj výrazně rychlejší, levnější a přesnější než jakákoli předchozí metoda úpravy DNA. A i když bylo jasné, že cesta z laboratoří do ordinací nebude jednoduchá, v medicíně už jsou první příklady využití tohoto postupu k léčbě jinak nevyléčitelných nemocí (první byla léčba srpkovité anémie schválená v roce 2023).
Prime time! Ale jen na chvíli
Jen pár dní po zveřejnění příběhu z Filadelfie pak lékaři – také v USA – představili jiný rekord z oboru úprav lidského genomu: Pacient se vzácným imunitním onemocněním postihujícím klíčový typ bílých krvinek (tzv. neutrofilů) se stal prvním člověkem, který dostal terapii využívající jinou pokročilou techniku z rodiny CRISPR – „prime editing“.
To je ještě všestrannější a potenciálně přesnější nástroj než bázová editace. Umožňuje nejen měnit jednotlivá písmena DNA, ale i přepisovat, vkládat nebo mazat krátké úseky genetického kódu.
V případě tohoto pacienta, teenagera, jehož jméno nebylo zveřejněno, šlo o vložení dvou chybějících genetických písmen do DNA jeho kmenových buněk. To by starší variace CRISPR metod spolehlivě nedokázaly.
Proces probíhal mimo tělo pacienta, tzv. ex vivo, jak bývá dnes u podobných metod obvyklé: Lékaři tedy odebrali pacientovi buňky, geneticky je upravili v laboratoři a pak mu je vrátili do těla (celý proces je pochopitelně o dost složitější, ale pro základní přehled to takto stačí).
První výsledky jsou nadějné: Pacient neměl vážné vedlejší účinky a jeho imunitní systém, jak se zdá, fungoval výrazně lépe než předtím.
Příběh má tedy alespoň prozatím šťastný konec pro daného pacienta, nikoliv však pro všechny ostatní zúčastněné. Firma Prime Medicine, která za vývojem stojí, i přes tyto pozitivní výsledky oznámila, že další vývoj této terapie z vlastních prostředků zastavuje.
Důvod je ekonomický: náklady na podobné „ex vivo“ léky. Ve společnosti tak došlo na propouštění čtvrtiny zaměstnanců, výměnu ředitele a pokles ceny akcií.
Už jednou citovaný David Liu, který je jedním z autorů metody „prime editing“ a spoluzakladatelem Prime Medicine (říkali jsme, že je hvězda), to okomentoval pro časopis Nature slovy: „Věda už pokročila dostatečně na to, aby editace genů mohla pomoci řadě pacientů. Ale v jádru nejde o problém vědecko-technologický, nýbrž ekonomický.“
Z čistě vědeckého a technologického hlediska totiž budoucnost genetické léčby vypadá opravdu extrémně nadějně. Tyto nástroje v posledních letech pravidelně dostávají „vylepšení“ a neustále se hledají nové a lepší.
Evoluční válka mezi bakteriemi a viry je totiž zdaleka nevyčerpanou studnicí inspirace pro vývoj dalších podobných nástrojů. Na obzoru se rýsují systémy jako Argonauti, TIGR-Tas, retrony nebo anti-CRISPR proteiny.
Potenciální výhody těchto nových nástrojů jsou různé: Jednodušší výroba, menší velikost pro snazší doručení do buněk, některé nevyžadují specifické DNA sekvence (PAM) pro svou funkci a mohou nabízet i nové funkce, například v diagnostice.
Ale k čemu pokrok, když si ho – podobně jako v případě léků společnosti Prime Editing – nebudou moci pacienti dovolit?
Technologie CRISPR.
Kdyby těch peněz nebylo…
Genové terapie obecně patří k nejdražším inovacím. Česká veřejnost o tom ví své například díky příběhu malého Martina, který by bez genové terapie s oficiální cenovkou 100 milionů korun nepřežil.
Jde o cenu i v rámci této kategorie terapií poměrně vysokou, ale ne úplně nezvyklou. Zolgensma pro spinální svalovou atrofii stojí kolem 50 milionů korun na pacienta. Hemgenix pro hemofilii B má v USA cenovku cca 80 milionů korun (3,5 milionu dolarů). První schválená CRISPR terapie Casgevy pro srpkovitou anémii byla oceněna na 2,2 milionu dolarů, konkurenční léčba Lyfgenia na 3,1 milionu dolarů.
Tyto sumy představují pro zdravotnické systémy nezvyklou a značnou zátěž. Například náklady Všeobecné zdravotní pojišťovny na takzvanou centrovou, tedy vysoce specializovanou léčbu, kam tyto terapie spadají, za posledních pět let vyskočily o 70 procent na částku 22,5 miliardy korun v roce 2024. Růst podobným tempem je dlouhodobě neudržitelný.
To značnou měrou přispívá k tomu, že zavádění těchto novinek do praxe je pomalé. Například rok po schválení zmíněné léčby srpkovité anémie Casgevy zahájilo proces léčby celosvětově jen něco málo přes 40 pacientů.
Na druhou stranu ceny nejsou tesané do kamene. Zastavme se například u ceny za vývoj těchto nových léků. Výrobci často argumentují, že za vysokými cenami jejich terapií stojí miliardové náklady na vývoj (v dolarech) a cena za dlouhá léta testování. Jak ukazuje případ malého KJ Muldoona, kterému lékaři připravili terapii na míru za pouhých šest měsíců, tato „výmluva za všechny miliardy“ rozhodně vždy neplatí.
Základy genových terapií, jako například zmiňovaný CRISPR nebo další, které jsou v základu současné vlny, využívají poznatky a technologie vyvinuté v rámci výzkumu financovaného z veřejných peněz. Firmy je nevyvíjejí od nuly.
Samozřejmě, i jen adaptace existující technologie pro novou mutaci je v podstatě novou terapií a přináší svá rizika – nikdo s jistotou neví, jaké nežádoucí účinky může konkrétní změna v DNA způsobit. Přesto postupy evidentně dozrály do takové podoby, kdy přizpůsobit je na míru danému pacientovi je otázkou měsíců a do budoucna to může být i méně. Tvrzení, že každý nový lék tohoto typu nevyhnutelně stojí miliardy dolarů, není pravdivé.
Mimochodem, vedoucí týmu, který léčbu pro KJ Muldoona vyvinul, odhadl cenu na 800 tisíc dolarů. V částce ovšem nejsou zřejmě zahrnuty náklady firem, které se na práci podílely a které ji v podstatě věnovaly jako sponzorský dar. A pochopitelně také žádný zisk.
Klíčové pro snížení nákladů budou technologické inovace ve výrobě a způsobu podání. Výrobní náklady i náklady na samotné provedení léčby mohou klesat i s tím, jak bude přibývat pacientů a zkušeností.
Velké naděje se vkládají do vývoje „hotových“ terapií. Místo aby se buňky upravovaly pro každého pacienta zvlášť, tak by se používaly předpřipravené buňky od zdravých dárců. Teoretické propočty naznačují, že například u některých dnes používaných terapií by cena jedné dávky mohla klesnout stonásobně. Významnou úsporu slibuje také automatizace výrobních procesů a zlepšení „výroby“ virů, které se někdy používají jako dopravní prostředky pro doručení genetického nákladu do buněk.
Tím, co by mohlo pravidla hry změnit nejzásadněji, je přitom podle řady odborníků možnost upravovat geny přímo v těle pacienta. Tedy například s pomocí injekce nanočástic nesoucích editační nástroje.
Odpadla by tak extrémně nákladná a logisticky složitá manipulace s buňkami v laboratoři mimo tělo pacienta, která je typická pro většinu současných genových a buněčných terapií. To by léčbu nejen dramaticky zlevnilo, ale i zjednodušilo a zpřístupnilo mnohem širšímu okruhu pracovišť a pacientů.
A co kdybychom to dělali jinak?
Inovují i plátci péče, tedy například zdravotní pojišťovny. Nejde jen o vyjednávání slev, ale také třeba o možnost rozložení astronomické platby do několika let nebo možnost platit jen za reálný a prokázaný výsledek léčby až po nějaké době – pokud léčba nezabere, pojišťovna pak nezaplatí plnou cenu.
Plátci prostě mají různé páky. V České republice se podařilo u některých CAR-T buněčných terapií (používaných pro léčbu některých typů rakoviny krve) srazit původní cenu zhruba na polovinu.
Svou roli může sehrát i konkurence. Pokud se pro jednu diagnózu objeví více alternativních terapií, výrobci mohou být nuceni jít s cenou dolů – mírný náznak tohoto trendu jsme viděli u srpkovité anémie, kde byla nová CRISPR terapie naceněna o něco níže než ta konkurenční. Jde ovšem o naprostou výjimku: Ve většině případů existuje jediný typ genové terapie na daný zdravotní problém, a výrobci tak nemusí s nikým přímo soutěžit.
Svou roli hraje i regulační prostředí. Například na úrovni Evropské unie se od roku 2025 chystá společné klinické hodnocení nových léků, což by mělo proces zefektivnit. Některé země také vytvářejí nákupní aliance, aby měly při jednání s farmaceutickými firmami silnější pozici – zvláště v těch případech, kdy v jediném státě může být jen pár pacientů, kteří danou terapii potřebují.
Ostatně historie medicíny nám dává jisté důvody k opatrnému optimismu. Vzpomeňme na monoklonální protilátky, dnes běžnou součást biologické léčby. Když kolem roku 2000 nastupovaly, jejich roční náklady na pacienta byly také ohromné: v některých případech i milion korun za rok.
Po vypršení patentové ochrany a s nástupem takzvaných biosimilárních přípravků (obdoba generik pro biologické léky) však jejich ceny výrazně poklesly. Podobný, i když ještě dramatičtější byl vývoj u léků na HIV nebo žloutenky typu C. Původně šokující ceny antivirotik se díky masové výrobě generik, mezinárodním dohodám a politickému tlaku propadly o několik řádů, což umožnilo léčit miliony lidí po celém světě.
Jistě, každá analogie má své limity, ale obecný trend je zřejmý: Mnoho revolučních lékařských inovací začíná jako velmi drahé a exkluzivní, ale kombinace různých faktorů může jejich dostupnost časem dramaticky zlepšit.
Jaká prognóza?
V krátkodobém horizontu, tedy v následujících zhruba pěti letech, pravděpodobně neuvidíme dramatický pokles ceníkových cen. Spíše můžeme očekávat další zdokonalování modelů financování a první výraznější náznaky konkurence na trhu.
Ve střednědobém horizontu, tedy asi za pět až 15 let, by se s příchodem většího počtu terapií a dalším technologickým pokrokem (zejména pokud se podaří prorazit v oblasti „in vivo“ podání) mohly jednotkové náklady začít citelněji snižovat.
Možná za pár desetiletí by se tak některé typy „editace genů“ mohly stát téměř rutinní součástí lékařské praxe. Ale to je nejspíše příliš optimistický scénář, který může nastat jen například v těch nejlépe vedených zdravotnických systémech světa.
Do té doby se příběhy podobné tomu malého Martínka mohou stále opakovat a vracet. Zmenšit propast mezi tím, co je možné a co je dostupné, nebude totiž ani v nejlepším případě jednoduché. Pokud jste v té pozici, že budete mít možnost v některých pomoci, určitě to zvažte. A i kdybyste nebyli, rozhodně na ně nezapomínejte a nechejte se jimi dojmout: z historie, například případu AIDS/HIV, dobře víme, že emoce veřejnosti mají vliv na „cenotvorbu“.
















